实验室污染之PCR污染如何处理
来源:网络 发布时间:2020-03-24 11:15:30
避免污染是实验室里的头等大事。生物实验大多数是微观的,基于细胞,分子,蛋白水平。而这些微观样本对外界环境的影响敏感,环境中的“杂质”乱入,如样本污染、试剂仪器交叉污染、产物气溶胶污染等,会对实验结果带来负面影响。
分子生物学检测方法,如PCR,因其高灵敏度、快速、操作方便等优势已经被广泛应用。不过正是由于它灵敏度极高,极微量的污染源都有可能导致检测结果的假阳性,所以对环境污染的控制也极为严格。
其中,气溶胶污染是非常重要却容易被忽视的。在操作时,比较剧烈地摇动反应管,开盖、吸样、污染进样枪的反复吸样都可形成气溶胶而污染。
定期大扫除清理、划分操作区域、试剂分装、操作谨慎、重复实验、多角度验证结果,这些都是实验室控制污染的方法。
但是污染源无处不在,特异性的,非特异性的,同源的,非同源的,广泛分布在样本容器、实验室台面、试剂溶液中、仪器表面、内管等等,所以对污染物的控制不仅仅是普通清理就能避免的,关键是需要从源头控制。
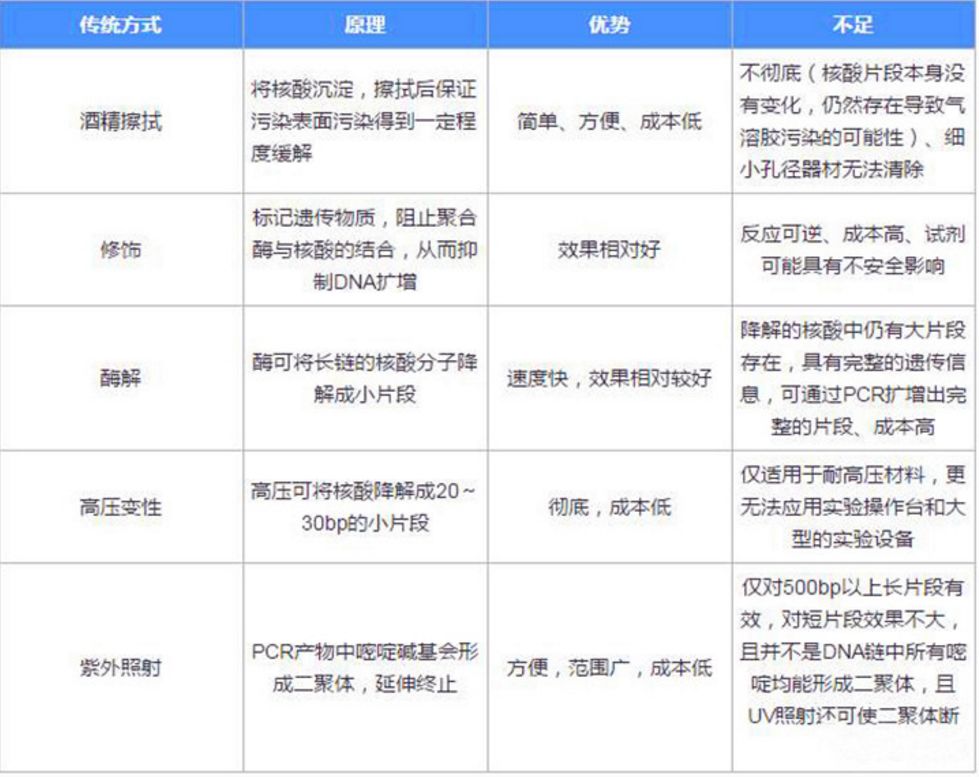
实验室大拿们都为了清除这些污染源研究出好多种方法,整理跟大家共享。
实验室内各工作区的实验用品,包括移液器等应专用。如有可能,应在装有紫外灯的层流式工作台(如生物安全柜、超净工作台)内,吸加PCR试剂,工作台内应放置PCR专业用的微量离心机、一次性手套、各量程的移液器和其他必须物品。
吸加PCR试剂和模板的操作应严格按要求进行,吸样要慢,尽量一次性完成,忌多次抽吸,以免交叉污染或产生气溶胶污染。
实验的过程中应勤换手套,在进出不同区域或进行模板操作后,都应及时更换手套。
装有PCR试剂的微量离心管在打开之前应先做瞬时离心(约10s),将管壁及管盖上的液体甩至管底部,从而减少污染手套或加样器的机会。开管动作要轻,以防管内液体溅出或形成气溶胶,造成污染。
在同时进行多个PCR反应时,应制备主反应混合液,再分装至PCR反应管,zui后添加样品核酸模板,以减少单个添加操作繁琐造成的污染。
实验室自己配置的试剂,如去离子水、缓冲液等,在使用之前均应高压灭菌或过滤除菌。
分装PCR试剂:所有的PCR试剂都应小量分装,以减少重复取样次数,并置于-20℃保存,适当时,最好做到专人专用。另外,PCR试剂、PCR反应液应与样品及PCR产物分开保存,不应放于同一冰盒或冰箱。
所有吸头、反应管等应一次性使用,使用之前,都应经过高压处理。若条件允许,最好使用带滤器的枪头。各工作区内的移液器要有标识,应固定使用用途,不能交叉使用。
实验设计方面应遵循实验室内部质量控制的相关规定,实验中至少应:
1. 设置目标DNA阳性对照反应。对靶序列所作的适当的稀释工作应于实验前在实验室内别的位置进行,这样可防止将靶DNA的浓溶液带到实验室中专门进行PCR的位置。
2. 设置PCR试剂阴性对照和目标DNA阴性对照反应。
实验室的合理设计与建设是顺利进行PCR实验的基础和保障,不合理的规划设计给后期实验的进行带来很多麻烦,从源头杜绝实验的麻烦,需要进行专业的学习。
文章来源网络,转载仅为知识分享,如有侵权,请联系删除。